Teoria atômica de Dalton
A teoria atômica de Dalton descreve o átomo como uma partícula esférica, maciça e indivisível, ideia que ficou conhecida como modelo da “bola de bilhar”. Dalton nasceu em Eaglesfield, um pequeno povoado da Inglaterra, tendo sido filho de tecelão e estudado na escola dos Quarks.
Começou a lecionar aos 12 anos, e, apesar de não ter diplomas, suas contribuições para a ciência são reconhecidas mundialmente; foi um dos pioneiros da química moderna; e identificou e descreveu uma anomalia na visão que hoje conhecemos como daltonismo.
Leia também: Representação de átomos, moléculas e substâncias segundo Dalton
Modelo atômico de Dalton
De acordo com a teoria atômica de Dálton, o átomo é maciço e indivisível, por isso é representado por esferas parecidas com bolas de bilhar, daí a famosa referência à sua ideia como “modelo bola de bilhar”.

Dalton defende também a existência de diferentes espécies atômicas, por isso, no caso de representações de dois ou mais átomos diferentes, usa-se simbologias diferentes, esferas de tamanhos e cores diferentes. Veja a seguir:
Contribuições de Dalton
- Criador da primeira teoria atômica moderna.
- Desenvolveu o conceito de massa atômica.
- Descobriu a anomalia congênita da visão que distorce a percepção das cores — daltonismo.
- Desenvolveu a lei de Dalton, que trata da pressão total em uma mistura gasosa relacionada à pressão parcial dos gases que a compõem.
- Em 1802, publicou, no Memórias do Lit & Phil, uma série de documentos intitulados “Ensaios experimentais”, que relatam suas observações científicas sobre o comportamento dos gases em diferentes condições de temperatura e pressão.
- Em 1803, apresentou à Literary and Philosophical Society (Sociedade Literária e Filosófica) um documento intitulado “Absorção dos gases pela água e outros líquidos”, no qual descreveu os princípios básicos utilizados na sua teoria atômica.
Postulados de Dalton
Dalton, em seus estudos sobre a matéria, desenvolveu alguns postulados. Alguns deles ainda são válidos e outros foram refutados pelas novas descobertas científicas. Confira todos a seguir:
- Toda matéria é constituída por partículas microscópicas chamadas átomos.
- Os átomos de um determinado elemento são iguais.
- Átomos de elementos diferentes são também distintos e podem ser identificados pela sua massa atômica relativa.
- Uma determinada substância pode ser formada pela combinação de dois ou mais átomos, sendo que, para essa substância, a combinação atômica em espécie e quantidade será sempre a mesma.
- Átomos são partículas indivisíveis e de ocorrência natural, não podem ser criados ou alterar-se sua formação. O que acontece em reações químicas é a alteração na combinação entre os átomos.
Veja também: Explicação de Dalton para as leis ponderais
Biografia de John Dalton
Nascido em 6 de setembro de 1766, no povoado Eaglesfield, na Inglaterra, e tendo sido filho de um tecelão, Dalton cresceu sobre influência da família Quarks, ganhou notoriedade como gênio da matemática e, ainda muito cedo, aos 12 anos, convenceu autoridades locais de que estava apto a substituir seu professor, John Fletcher.
Oficialmente Dalton não possuía curso superior, mas seu interesse e aptidão pelos estudos tornou-o um aluno autodidata. No New College, em Londres, foi professor de química, física e matemática. No entanto, seu destaque científico deveu-se ao resgate da atomística, em que ele desenvolveu o primeiro modelo atômico, que conhecemos como modelo bola de bilhar; e também aos seus estudos sobre a disfunção na visão que faz com que o indivíduo não diferencie as tonalidades de cores primárias, distúrbio do qual ele era portador e que por isso ficou conhecido como daltonismo.
Dalton sofreu três AVCs (Acidente Vascular Cerebral) nos anos de 1837, 1838 e 1844, mas ainda se manteve trabalhando em suas observações meteorológicas. No dia 27 de julho de 1844, foi encontrado morto pela sua atendente.
Exercícios resolvidos
Questão 1 - (Unesp) Observe as figuras 1, 2 e 3.
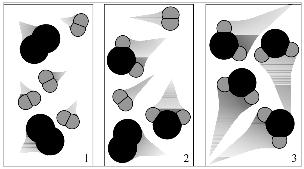
Elas podem representar diferentes momentos de uma reação entre:
A) os gases oxigênio e hélio.
B) os gases hidrogênio e oxigênio.
C) os gases hidrogênio e hélio.
D) os gases nitrogênio e cloro.
E) moléculas de iodo e oxigênio.
Resolução
Alternativa B. Como se pode observar na imagem, trata-se de moléculas di-atômicas, e, no quadro 1, essas moléculas são combinações feitas com átomos da mesma espécie. Deduz-se que são o oxigênio e o hidrogênio porque o hidrogênio é o menor átomo conhecido, sendo, portanto, representado, de acordo com o modelo atômico de Dalton, por esferas pequenas.
Questão 2 - Analise as afirmativas sobre John Dalton:
I- Dalton era um assíduo estudante, não possuía diplomas, mas desenvolveu-se como cientista por ser autodidata.
II- Daton era portador da disfunção na visão que distorce a distinção das cores primárias.
III- Filho de camponês, Dalton começou a lecionar aos 12 anos para ajudar a família financeiramente.
Estão corretas:
A) I e II
B) II e III
C) I e III
D) Todas estão corretas.
E) Todas estão incorretas.
Resolução
Alternativa A. A afirmativa III está incorreta, pois Dalton não era filho de camponês, e sim de um tecelão.
Questão 3 - (Enem 2019) Em 1808, Dalton publicou o seu famoso livro, intitulado Um novo sistema de filosofia química (do original A new system of chemical philosophy), no qual continha os cinco postulados que serviam como alicerce da primeira teoria atômica da matéria fundamentada no método científico. Esses postulados são numerados a seguir:
1. A matéria é constituída de átomos indivisíveis.
2. Todos os átomos de um dado elemento químico são idênticos em massa e em todas as outras propriedades.
3. Diferentes elementos químicos têm diferentes tipos de átomos; em particular, seus átomos têm diferentes massas.
4. Os átomos são indestrutíveis e nas reações químicas mantêm suas identidades.
5. Átomos de elementos combinam-se com átomos de outros elementos em proporções de números inteiros pequenos para formar compostos.
Após o modelo de Dalton, outros modelos baseados em outros dados experimentais evidenciaram, entre outras coisas, a natureza elétrica da matéria, a composição e organização do átomo e a quantização da energia no modelo atômico.
OXTOBY, D.W.; GILLIS, H. P.; BUTLER, L. J. Principles of modern chemistry. Boston: Cengage Learning, 2012. (Adaptado)
Com base no modelo atual que descreve o átomo, qual dos postulados de Dalton ainda é considerado correto?
A) 1
B) 2
C) 3
D) 4
E) 5
Resolução
Alternativa E. A combinação dos átomos em mesma proporção e espécie para formação de compostos iguais ainda é valida e reafirmada pelo enunciado de Antoine Laurent de Lavoisier, na lei da conservação das massas.
Artigos Relacionados

Últimas notícias
Outras matérias


















