Ruptura de ligações em compostos orgânicos
Nas reações orgânicas é comum o carbono não efetuar suas quatro ligações, o que abre espaço para a formação de grupos intermediários instáveis. Tais grupos se originam da ruptura de ligações entre átomos, que pode ocorrer de modo homogêneo ou heterogêneo, vejamos:
Cisão Homolítica
Como o nome já diz, a ruptura é feita de modo igual, o que resulta na formação de radicais livres.
A quebra homolítica se dá em meio a uma alta energia. A reação com moléculas apolares ou com baixa diferença de eletronegatividade torna possível sua ocorrência, acompanhe o exemplo:
.jpg)
Ao final da reação temos o radical livre: um átomo com elétron desemparelhado que tem carga elétrica igual a zero.
Repare que ambos os participantes da ruptura homolítica, tanto o hidrogênio (H) como o carbono (C), ficaram com seu elétron original da ligação.
Cisão Heterolítica
Nesse caso, os produtos finais da reação são íons com carga positiva (cátions) ou carga negativa (ânions).
A quebra desigual da molécula faz com que o par eletrônico fique com apenas um dos átomos da ligação, veja os exemplos:
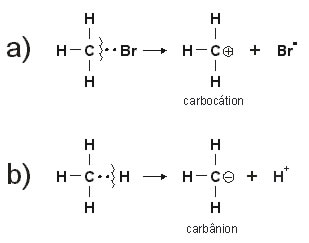
Em ambos os casos temos a formação de íons, o que muda é a carga positiva ou negativa.
a) a quebra heterolítica da ligação entre carbono e bromo dá origem ao íon brometo (carga negativa) e ao carbocátion. O Br fica com o par eletrônico porque é mais eletronegativo.
b) a quebra heterolítica da ligação entre carbono e hidrogênio resulta na formação de um carbânion e um íon H+ (próton).
As rupturas heterolíticas ocorrem normalmente em ligações polarizadas a uma baixa energia e na presença de solventes polares.
Por Líria Alves
Graduada em Química
Cisão Homolítica
Como o nome já diz, a ruptura é feita de modo igual, o que resulta na formação de radicais livres.
A quebra homolítica se dá em meio a uma alta energia. A reação com moléculas apolares ou com baixa diferença de eletronegatividade torna possível sua ocorrência, acompanhe o exemplo:
.jpg)
Ao final da reação temos o radical livre: um átomo com elétron desemparelhado que tem carga elétrica igual a zero.
Repare que ambos os participantes da ruptura homolítica, tanto o hidrogênio (H) como o carbono (C), ficaram com seu elétron original da ligação.
Cisão Heterolítica
Nesse caso, os produtos finais da reação são íons com carga positiva (cátions) ou carga negativa (ânions).
A quebra desigual da molécula faz com que o par eletrônico fique com apenas um dos átomos da ligação, veja os exemplos:

Em ambos os casos temos a formação de íons, o que muda é a carga positiva ou negativa.
a) a quebra heterolítica da ligação entre carbono e bromo dá origem ao íon brometo (carga negativa) e ao carbocátion. O Br fica com o par eletrônico porque é mais eletronegativo.
b) a quebra heterolítica da ligação entre carbono e hidrogênio resulta na formação de um carbânion e um íon H+ (próton).
As rupturas heterolíticas ocorrem normalmente em ligações polarizadas a uma baixa energia e na presença de solventes polares.
Por Líria Alves
Graduada em Química
Publicado por Líria Alves de Souza

Matemática do Zero
Matemática do Zero | Polígono convexo e não convexo
Nessa aula veremos o que é um polígono convexo e um polígono não convexo a partir da definição matemática e, posteriormente, um “macete”.
Últimas notícias
Outras matérias
Biologia
Matemática
Geografia
Física
Vídeos

Saúde e bem-estar
Leptospirose
Foco de enchentes pode causar a doença. Assista à videoaula e entenda!

Gramática
Inglês
Que tal conhecer os três verbos mais usados na língua inglesa?

Matemática
Regra de três
Com essa aula você revisará tudo sobre a regra de três simples.















