Processos endotérmicos e exotérmicos

A Termoquímica estuda as reações químicas e as mudanças de estado físico que envolvem trocas de energia na forma de calor. Entre esses processos, temos basicamente dois:
- Processos exotérmicos:

Genericamente, temos:
Reagentes → Produtos + calor
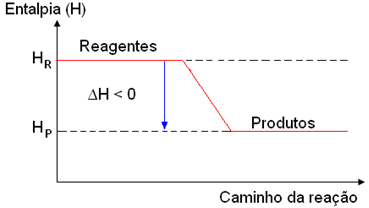
Visto que os reagentes perderam parte de seu conteúdo energético, o valor da entalpia (H) ou valor da energia global dos produtos (HP) é menor do que a entalpia dos reagentes (HR) nos processos exotérmicos e, consequentemente, a variação da entalpia (ΔH) será negativa.
ΔH = HP - HR (HP < HR)
ΔH < 0
Reagentes → Produtos ΔH < 0
Graficamente, podemos representar esse tipo de reação da seguinte forma:
Todos os processos de combustão são reações exotérmicas. Um exemplo é a combustão do hidrogênio, que atinge cerca de 2500 ºC, fornecendo a energia mecânica necessária para o foguete se movimentar e escapar da gravidade da Terra.

A seguir temos outros exemplos de reações e processos exotérmicos comuns no cotidiano. Observe que em todos os casos há uma sensação de aquecimento, pois o calor é liberado para o meio.

- Processos endotérmicos:

Reagentes + calor → Produtos
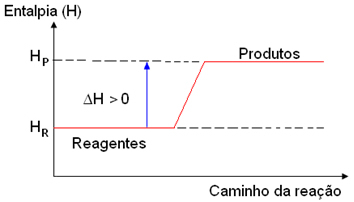
Aqui ocorre o contrário do que vimos anteriormente, a entalpia dos produtos (HP) é maior do que a entalpia dos reagentes (HR) porque os reagentes absorveram o calor fornecido pelo meio e, dessa forma, a variação da entalpia (ΔH) será positiva:
ΔH = HP - HR (HP > HR)
ΔH > 0
Reagentes → Produtos ΔH > 0
Os gráficos dos processos endotérmicos ficam com o seguinte aspecto:
Por exemplo, nas siderúrgicas 1 mol de hematita absorve 491,5kJ para se transformar no ferro metálico:
Fe2O3(s) + 3 C(s) → 2 Fe(s) + 3 CO(g) ΔH = 491,5 kJ

Nos outros exemplos abaixo, você perceberá que nas reações e processos endotérmicos há uma sensação de resfriamento, pois o calor do meio é absorvido:

Artigos Relacionados

Últimas notícias
Outras matérias


















