Pilha seca de Leclanché

A pilha seca ácida foi desenvolvida em 1866, pelo químico francês George Leclanché (1839-1882). Ela é a pilha mais comum hoje em dia, pois é a mais barata e a mais usada em lanternas, rádios, equipamentos portáteis e aparelhos elétricos como gravadores, flashes e brinquedos.
Essa pilha na verdade não é seca, pois dentro dela há uma pasta aquosa, úmida, mas ela recebeu esse nome para diferenciá-la (porque era revolucionária, na época em que foi criada) das primeiras pilhas até então conhecidas, como a pilha de Daniell (imagem abaixo), que utilizavam recipientes com soluções aquosas.
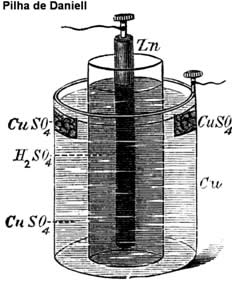
A pilha seca produz uma voltagem de apenas 1,5 V, mas pode ser melhorada com seu uso descontínuo, ou seja, alternar períodos de uso com repouso fora do produto.
A sua composição é dada segundo o esquema básico das partes principais da reação eletroquímica a seguir:
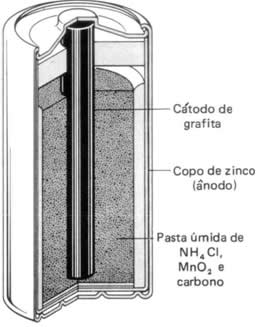
Dentro da pilha temos o ânodo (polo negativo) e o cátodo (polo positivo), que são formados por:
| Ânodo: oxidação que ocorre no zinco metálico que fica no envoltório da pilha. |
Zn (s) → Zn2+ (aq) + 2 e-
| Cátodo: Redução do manganês de NOX +4 (MnO2) para +3 (Mn2O3) presente na pasta úmida que fica na parte interna da pilha. |
2 MnO2(aq) + 2 NH4 1+ (aq) + 2e- → 1 Mn2O3 (s) + 2NH3(g) + 1 H2O(l)
Essa mistura pastosa é constituída de cloreto de amônio (NH4Cl), óxido de manganês (MnO2)e carbono pulverizado. O zinco transfere os seus elétrons para o manganês por meio da barra de grafita central, que em razão disso é considerada o polo positivo do circuito externo da condução dos elétrons.
Assim, temos como reação global de funcionamento da pilha seca ácida:
Zn (s) + 2 MnO2(aq) + 2 NH4 1+ (aq) → Zn2+ (aq) + 1 Mn2O3 (s) + 2NH3(g)
Seu funcionamento cessa definitivamente quando todo o dióxido de manganês é convertido em trióxido de manganês. Essa reação é irreversível, por isso essas pilhas são não recarregáveis.

Últimas notícias
Outras matérias


















