Número atômico e número de massa dos átomos
Por meio do modelo atômico de Rutherford, algumas características dos átomos passaram a relacionar as cargas elétricas com suas partículas constituintes; sendo que os prótons são positivos; os elétrons, negativos; e os nêutrons não apresentam carga.
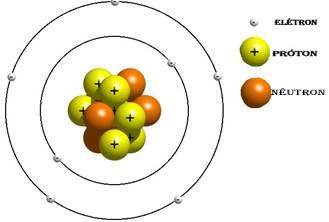
Com base nessas informações, foram definidos alguns conceitos diretamente relacionados a essas partículas, suas cargas e seus números, que servem para identificar os átomos, como o número de massa (A) e o número atômico (Z).
A seguir, esses conceitos serão definidos:
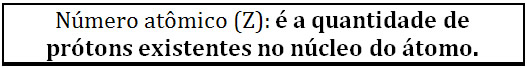
Por exemplo, abaixo temos alguns elementos e as informações fornecidas pela Tabela Periódica. O número atômico (Z) vem em cima do respectivo elemento, indicando quantos prótons ele tem no núcleo. Observe como isso se dá:
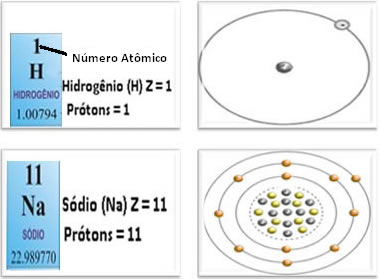
Observe que a quantidade de prótons, ou o número atômico, no átomo de sódio acima, é igual à quantidade de elétrons, quando o átomo está em seu estado neutro.
![]()
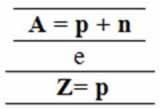
Então:
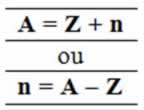
Ou seja, o número de massa é a quantidade de partículas presentes no núcleo do átomo.
Exemplo: “O elemento sódio possui 11 prótons e 12 nêutrons, qual seu número de massa (A)?”.
A = p + n
A = 11+12
A = 23
A partir dessa fórmula é possível também descobrir quantos nêutrons existem em determinado átomo, como no caso a seguir:
“Um átomo de ferro (Z= 26) possui número de massa igual a 56. Quantos nêutrons existem em seu núcleo?”
n = A – Z
n = 56 – 26
n = 30
Na representação de um elemento químico, o número de massa (A) aparece na parte superior; e o número atômico vem na parte inferior, conforme mostrado a seguir: ZXA .
Exemplo: 11Na23.
Artigos Relacionados

Últimas notícias
Outras matérias


















