Lei de Hess

O químico suíço Germain Henry Hess (1802-1850) teve uma grande contribuição para a química, mas especificamente para a Termoquímica, seus estudos envolvem a entalpia de reações químicas. Graças a este cientista é possível calcular a variação de entalpia, a Lei de Hess recebeu este nome em homenagem ao seu criador e tem a seguinte definição:
Para uma dada reação, a variação de entalpia depende apenas do estado inicial dos reagentes e do estado final dos produtos, esteja essa reação ocorrendo em uma ou várias etapas.
Um exemplo pode auxiliar no entendimento desta lei: se você fosse fazer um passeio e para chegar ao seu destino tivesse à sua disposição dois caminhos, um mais longo e um mais perto, qual deles você tomaria? É claro que o atalho é o preferido, mas de qualquer forma o destino final é o mesmo, ou seja, o local de partida e o de chegada não muda, o que muda é a trajetória escolhida. A variação de entalpia em uma reação também funciona assim: ela depende apenas do estado inicial e final e independe dos estados intermediários.
Agora veja a aplicação da lei de Hess na passagem da água do estado líquido para o estado gasoso. A variação de entalpia é representada por ?H:
H20(l) → H20(g) ?H = + 44 KJ
Repare que nesta equação a passagem de 1 mol de H20(l) para o estado gasoso foi feita numa única etapa, veja abaixo como obter o mesmo produto em duas etapas:
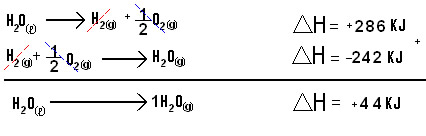
A equação global nos permite verificar que o ?H (final) de uma reação pode ser obtido pela soma algébrica dos ?H de reações intermediárias.
Através das demonstrações acima podemos concluir que a variação de entalpia (?H) é a mesma, seja a reação realizada em uma ou várias etapas como especifica a Lei de Hess.
Artigos Relacionados

Últimas notícias
Outras matérias


















