Estereoisomeria ou Isomeria Espacial

A Estereoisomeria pode ser explicada e visualizada somente por meio de fórmulas espaciais. Esteroisômeros são compostos que possuem o mesmo grupo funcional, o mesmo tipo de insaturação, a mesma estrutura, heteroátomo ou substituinte. Eles se diferem apenas pela configuração das moléculas, isto é, pelo arranjo espacial dos átomos.
1º) Compostos saturados:
Quando sofrem uma rotação em torno das ligações simples, os átomos das moléculas isômeras adquirem arranjos atômicos diferentes. Por exemplo, observe os modelos das moléculas do etano a seguir, caracterizados por meio da representação de Newman e fórmulas em cavalete das moléculas do Etano:
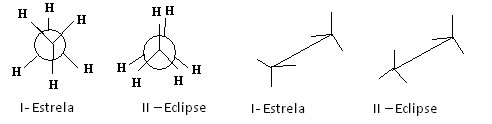
Respectivamente: Projeção de Newman e fórmulas em cavalete das moléculas do Etano
A molécula do etano na conformação I- estrela é a mais estável porque passa por um mínimo de energia potencial. Conforme vai rotacionando, esta energia vai aumentando e, ao adquirir a conformação II- eclipse, atinge o seu máximo. Dessa forma, a maioria das moléculas do etano encontra-se na forma I – estrela, ou seja, na conformação mais estável.
2º) Compostos insaturados de cadeias abertas (acíclicas) e de cadeias cíclicas:
Ao contrário dos compostos saturados vistos anteriormente, os compostos insaturados não sofrem rotação, pois a ligação dupla é rígida e isso causaria o seu rompimento.
a) Diasteroisômeros cis-trans em compostos insaturados de cadeia aberta:
Neste caso, os ligantes de cada átomo de carbono da dupla são diferentes entre si. Observe os exemplos de isômeros geométricos do 1,2 – dicloroeteno abaixo.
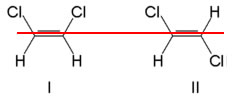
Isômeros geométricos do 1,2 – dicloroeteno
b) Diasteroisômeros cis-trans em compostos de cadeias cíclicas (fechadas):
Os compostos cíclicos também não sofrem uma rotação completa em torno de seus eixos, porque sua estrutura é rígida e isso causaria o rompimento do ciclo.
Neste caso, para que ocorra isomeria cis-trans, é necessário que pelo menos dois carbonos do ciclo possuam ligantes diferentes entre si e iguais aos de outro átomo de carbono.
Seguindo a mesma regra para os compostos insaturados de cadeia fechada, traçamos uma reta imaginária, separando os eixos do plano espacial destes átomos de carbono e observando se seus ligantes iguais estão do mesmo lado (cis) ou de lados opostos (trans).
Exemplo:

Isômeros do 1,2-diemtilciclopentano.
3º) Isomeria E-Z:
Este sistema E-Z foi criado pelo químico orgânico inglês Christopher Kelk Ingold (1893-1970), pelo químico orgânico bósnio e naturalizado suíço Vladimir Prelog (1906-1998) e colaboradores. Ele serve para acabar com um impasse denominado cis-trans, quando se aplica a alcenos cujos átomos da dupla possuem mais de dois ligantes diferentes.
No sistema E-Z tem maior prioridade o ligante cujo átomo imediatamente ligado ao carbono da dupla tiver maior número atômico. Por exemplo, considerando os isômeros do 3- metilpent – 2 –eno, temos:
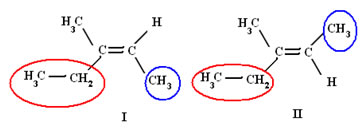
Isômeros do 3- metilpent –2–eno
O isômero I é denominado Z-3- metilpent–2–eno, porque os ligantes de maior número atômico de cada carbono da dupla estão do mesmo lado (a letra Z vem da palavra alemã zusammen, que significa junto; e a letra E, vem da palavra alemã entgegen, que significa oposto). Já o isômero II, é denominado E-3-metilpent–2–eno, pois os ligantes de maior número atômico de cada carbono da dupla estão de lados opostos.
A mesma regra vale para a denominação dos compostos cíclicos.
Por Jennifer Fogaça
Graduada em Química
Artigos Relacionados

Últimas notícias
Outras matérias


















