Entropia

Essa desordem tem a ver com a espontaneidade do processo físico. Por exemplo, quando um gelo derrete, ou seja, passa pelo processo físico de fusão, do estado sólido para o líquido, esse é um processo espontâneo em que a desordem das moléculas de água aumentará.
No estado sólido elas estão mais próximas umas das outras e num sistema mais organizado e rígido. Já no estado líquido, elas ficam mais espaçadas e com maior liberdade de movimento. Com o aumento da desordem do sistema, dizemos então que se aumenta a entropia.
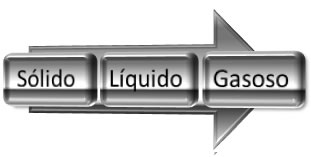
Se essa água no estado líquido for aquecida e passar para o estado de vapor, a desordem das moléculas aumentará ainda mais; desse modo, podemos generalizar que o aumento da entropia em mudanças de estado físico ocorre no seguinte sentido:
A segunda Lei da Termodinâmica diz que toda mudança espontânea ou natural causa um aumento da entropia do sistema e de sua vizinhança. Outro exemplo que demonstra isso e que é um processo natural é a dissociação iônica do cloreto de sódio (NaCl – sal de cozinha), quando é dissolvido em água:
NaCl(s) → Na+(aq) + Cl– (aq)
Nesse caso, como é um processo espontâneo, sabemos que a entropia irá aumentar. O aumento da desordem desse sistema é fácil de ser percebida, pois os íons em solução estão mais desorganizados do que no sólido.
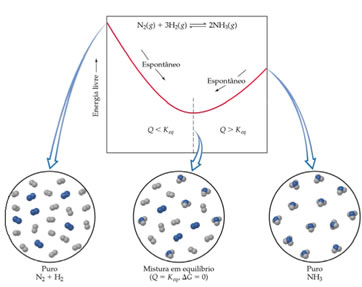
Um exemplo no qual a entropia diminui, ocorre na formação da amônia a partir do nitrogênio e do hidrogênio; pois o número de moléculas na fase gasosa diminui, assim a desordem também é menor. Na figura a seguir isso é mostrado, relacionando-se também com a energia livre (ΔG) e com a constante de equilíbrio (Keq). Observe como a quantidade de moléculas do sistema diminui, tornando-o mais organizado:
Se quisermos calcular a variação de entropia (ΔS) que ocorrerá em cada processo, podemos fazer isso por meio da fórmula matemática abaixo:

Onde: qrev = energia de forma reversível como calor e
T = temperatura.
Quanto maior for a energia transferida na forma de calor, maior será a desordem do sistema, principalmente para situações em que as temperaturas forem baixas. E se a temperatura do sistema for diferente da temperatura da vizinhança, a entropia também aumentará.
Pode-se também relacionar a variação da energia (ΔE) com a variação da entropia (ΔS), conforme a equação:

Essa relação é possível porque a energia na forma de calor transferido nunca é totalmente transformada em trabalho; assim, a parte da energia que é dissipada se transforma em entropia.
O conceito de entropia é de extrema importância quando estudamos a desordem crescente que tem havido no planeta, em razão do aumento da exploração de seus recursos, desmatamento, poluição, entre outras fontes de degradação. Quando maior for essa degradação, maior será a entropia do planeta, que poderá chegar a um estágio tão elevado que a vida na Terra não será mais possível.
Artigos Relacionados

Últimas notícias
Outras matérias


















