Eletrólise em meio aquoso
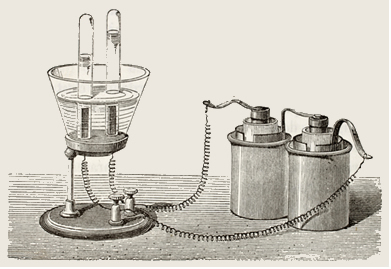
A eletrólise em meio aquoso é um processo em que se passa corrente elétrica através de uma solução aquosa, onde existem íons que produzem reações, gerando energia química.
Visto que é necessário que se passe uma corrente elétrica, esse processo não é espontâneo e é exatamente o contrário de uma pilha, que é um equipamento que transforma energia química em elétrica de modo espontâneo.
Na solução aquosa, a substância diluída se dissocia ou ioniza, liberando íons para o meio. Mas existem também os íons provenientes da ionização da água:
H2O → H+ + OH-
Apesar de haver tantos íons na solução, apenas um cátion e um ânion sofrerão a descarga nos eletrodos. Para sabermos quais serão eles, se são os íons da água ou os íons da substância diluída, temos que considerar uma ordem de prioridade, que é dada abaixo:
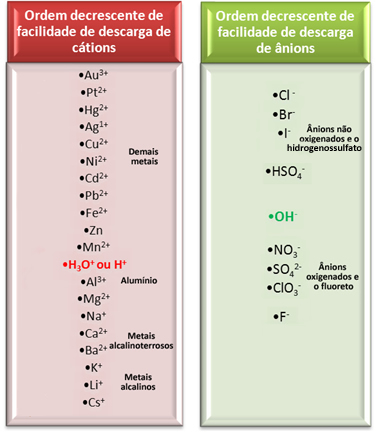
Observe que os cátions de metais alcalinos, de metais alcalinoterrosos e do alumínio não se descarregam em solução aquosa. Nesses casos, se o meio for neutro, a redução que ocorrerá no cátodo será a da água, mas se for em meio ácido, a redução será a do cátion H+, formando o gás hidrogênio, H2. Se quisermos produzir esses metais alcalinos, alcalinoterrosos e o alumínio, terá que ser por eletrólise ígnea, que ocorre sem a presença de água, com o material fundido.
Os cátions dos demais metais sofrem redução no eletrodo negativo, depositando seu respectivo metal. Por exemplo, se for o cátion prata (Ag1+(aq)), será depositada a prata metálica no eletrodo negativo (Ag0(s)).
Quanto aos ânions, veja que os que são oxigenados e o fluoreto nunca se oxidam em solução aquosa, mas sim os ânions da água. Se o meio for neutro, a água se oxidará no eletrodo positivo, produzindo gás oxigênio; mas se o meio for básico, os seus ânions hidroxila (OH-(aq)) serão oxidados.
Os ânions não oxigenados Cℓ-, Br- e I- oxidam-se gerando no eletrodo positivo as substâncias elementares cloro, bromo e iodo, respectivamente.
Vejamos um exemplo para entender melhor como isso ocorre:
Considere que numa cuba eletrolítica seja colocada uma solução aquosa de sulfato de cobre II (CuSO4(aq)), com dois eletrodos mergulhados nela. Esses eletrodos estão ligados a um gerador de corrente elétrica, como mostra a figura:
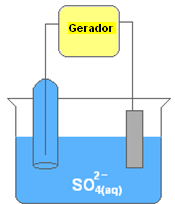
Na solução, temos os íons gerados pelo sulfato de cobre e os da água:
CuSO4(aq) → Cu2+(aq) + SO2-4(aq)
H2O(ℓ) → H+(aq) + OH-(aq)
Os cátions disponíveis são Cu2+(aq) e H+(aq). Se olharmos na ordem de facilidade de descarga, o cátion cobre tem maior poder oxidante, sofrendo redução no eletrodo negativo (cátodo) e depositando o metal cobre nele.
Semirreação do cátodo: Cu2+(aq) + 2 e- → Cu(s)
Entre os ânions SO2-4(aq) e OH-(aq), os ânions hidroxila têm maior facilidade de oxidação, gerando gás oxigênio no eletrodo positivo (ânodo):
Semirreação do ânodo: 2 OH-(aq) → H2O(ℓ) + ½ O2(g)+ 2 e-
A reação global dessa reação é dada por:
CuSO4(aq) → Cu2+(aq) + SO2-4(aq)
2 H2O(ℓ) → 2 H+(aq) + 2 OH-(aq)
Semirreação do cátodo: Cu2+(aq) + 2 e- → Cu(s)
Semirreação do ânodo: 2 OH-(aq) → H2O(ℓ) + ½ O2(g)+ 2 e-
Reação global: CuSO4(aq) + H2O(ℓ) → 2 H+(aq) + SO2-4(aq) + Cu(s) + ½ O2(g)
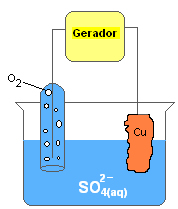
Como produtos dessa eletrólise foram obtidos o cobre metálico e o gás oxigênio. Além disso, a solução é ácida, pois apresenta os íons H+ que não foram reduzidos.
Artigos Relacionados

Últimas notícias
Outras matérias


















